La combustion ne peut se produire que si l’on réunit trois éléments : un combustible, un comburant, une énergie d’activation. C’est pourquoi on parle du « triangle du feu ».
La disparition de l’un des trois éléments suffit à arrêter la combustion.

La combustion ne peut se produire que si l’on réunit trois éléments : un combustible, un comburant, une énergie d’activation. C’est pourquoi on parle du « triangle du feu ». La disparition de l’un des trois éléments suffit à arrêter la combustion. |
|
On réalise la combustion d’un morceau de charbon dans du dioxygène.
Schéma et Observation :
|
Observation : La combustion est vive et rapide |
Questions : Pourquoi la combustion s’arrête ?
Quel peut-être le gaz présent dans le flacon ?
Il n’y a plus de dioxygène, le gaz présent est peut-être du dioxyde de carbone. On fait le test de l’eau de chaux.
L’eau de chaux se trouble, le test est positif, il y a du dioxyde de carbone.
Bilan : |
Carbone + Dioxygène |
→ |
Dioxyde de carbone |
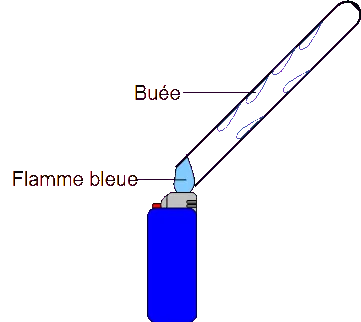
La combustion du butane est complète lorsque la flamme que l’on peut observer est bleue. On veut vérifier quels sont les produits de la réaction.
On place le tube à essais au-dessus de la flamme bleue (pas de flamme jaune) pendant une minute et on bouche le tube.
Quel
produit est visible sur les parois du tube ?
De la buée
(donc de l’eau).
Réalise le test à l’eau de chaux, que peut-on en déduire ?
Le test est positif, un des produits est du dioxyde de carbone.
Donne
le nom des réactifs et des produits et écrit le bilan de la
combustion du butane.
Réactifs :
Butane et dioxygène
Produits :
Eau et Dioxyde de carbone
Bilan : |
Butane + Dioxygène |
→ |
Dioxyde de carbone + Eau |
La combustion du butane est incomplète lorsque la flamme que l’on peut observer est jaune.
On place une coupelle au-dessus de la partie jaune de la flamme.
Qu’observe-t-on ? On observe un dépôt noir de carbone.
On obtient aussi un gaz très dangereux, car il est inodore, incolore et toxique : C’est le monoxyde de carbone.
Au cours d’une réaction chimique la masse se conserve. La masse des réactifs est égale à la masse des produits donc le nombre total d’atomes ne change pas.
Applications
Écrire le bilan de la réaction, puis les formules chimiques et les schémas :
La combustion du carbone
Bilan : |
Carbone |
+ |
Dioxygène |
→ |
Dioxyde de carbone |
Modélisation : |
|
+ |
|
→ |
|
Équation-bilan : |
C |
+ |
O2 |
→ |
CO2 |
La combustion du méthane (CH4) (Même produits qu’avec la combustion du butane)
Bilan : |
Méthane |
+ |
Dioxygène |
→ |
Eau |
+ |
Dioxyde de Carbone |
Modélisation : |
|
+ |
|
→ |
|
+ |
|
Équation-bilan : |
CH4 |
+ |
O2 |
→ |
H2O |
+ |
CO2 |
Impossible :
Le nombre d’atome n’est pas conservé,
on doit corriger la
représentation
Dans une équation-bilan, il faut que l’on puisse voir que le nombre d’atomes reste le même, il faut équilibrer. Seul le nombre de molécules peut-être changé.
Reprends l’équation précédente et équilibre là à l’aide des modèles moléculaires.
Bilan : |
Méthane |
+ |
Dioxygène |
→ |
Eau |
+ |
Dioxyde de Carbone |
Modélisation : |
|
+ |
|
→ |
|
+ |
|
Équation-bilan : |
CH4 |
+ |
2O2 |
→ |
2H2O |
+ |
CO2 |
Même chose avec la synthèse de l’eau à partir du dioxygène et du dihydrogène (H2).
Bilan : |
Dihydrogène |
+ |
Dioxygène |
→ |
Eau |
Modélisation : |
|
+ |
|
→ |
|
Équation-bilan : |
2H2 |
+ |
O2 |
→ |
2H2O |
Même chose avec la synthèse de l’ammoniac (NH3) à partir du diazote et du dihydrogène.
Bilan : |
Diazote |
+ |
Dihydrogène |
→ |
Ammoniac |
Modélisation : |
|
+ |
|
→ |
|
Équation-bilan : |
N2 |
+ |
3H2 |
→ |
2NH3 |
Vérification d’une équation-bilan
Pour vérifier qu’une équation-bilan est correctement équilibrée, on doit vérifier le nombre d’atomes dans les réactifs et les produits pour chaque type d’atome.
On vérifie pour chaque atome, le nombre dans les réactifs et dans les produits.
Exemples
Combustion du fer
Fer + Dioxygène → Oxyde de Fer |
|||||
|
|
+ |
|
|
|
Fer |
|
|
|
= |
|
Oxygène |
|
|
|
= |
|
Combustion de l’aluminium (compléter)
Aluminium + Dioxygène → Oxyde d’aluminium |
|||||
|
|
+ |
|
|
|
Aluminium |
|
|
|
= |
|
Oxygène |
|
|
|
= |
|
Combustion du butane (corriger, une seule erreur de coefficient)
Butane + Dioxygène → Eau + Dioxyde de carbone |
|||||||
|
|
+ |
|
|
|
+ |
|
|
|
|
|
|
|
|
|
Carbone |
|
|
|
= |
|
|
|
Hydrogène |
|
|
|
= |
|
|
|
Oxygène |
|
|
|
= |
|
+ |
|
|
|
+ |
|
|
|
+ |
|