

« insécable » signifie que l'on ne peut pas couper.
Aristote refuse le modèle particulaire.
Avogadro nomme « molécules » les particules de la matière.
Atome signifie insécable en grec ancien.
Les molécules sont entourées de vide.
Aristote pense que les particules de gaz tomberaient si elles étaient entourées de vide.
Activité scénique : « Je suis une molécule d’eau ».
Faire la description des trois états :
Solide |
Liquide |
Gaz |
…. |
... |
... |
Observation de modélisation (Logiciel Animol):
On observe les molécules de l'air, 1/5 de dioxygène et 4/5 de diazote qui sont dispérsées et désordonnées. En percuttant les parois, elles produisent de la pression. |
|
Modélisation de la dissolution du permanganate de potassium dans l'eau.
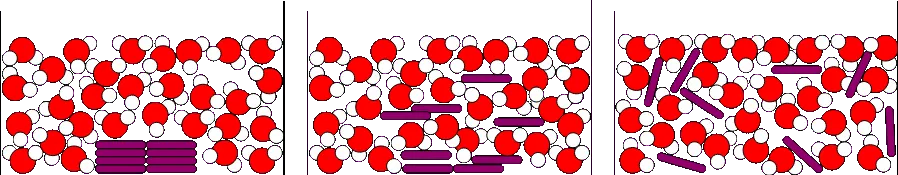
Est-ce que le nombre de molécules change pendant la dissolution ?
Où trouve-t-on les molécules de permanganate de potassium à la fin de la dissolution ?
Que peut-on en déduire sur la masse totale pendant une dissolution ?
Lors de la dissolution, le nombre de molécule d'eau et de permanganate de potassium ne change pas.
À la fin de la dissolution, les molécules de permanganate de potassium sont dispersées dans l’eau.
La masse totale est constante lors de la dissolution.
Modélisation des changements d'états du diiode dans l'air.
>> Fusion >> |
|
>> Vaporisation >> |

Quelle est la formule du dioxygène? : |
O2 |
Quelle est la formule de l'eau ? : |
H2O |
Dessiner la molécule d'eau : |
|
Les atomes
|
Les molécules
|