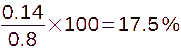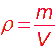4ème Chapitre 5 : L’air Thème 1
I -L'atmosphère et sa composition
Lire l'activité
documentaire et répondre aux questions.
Lavoisier veut prouver que
l'air est composé de deux sortes de gaz.
L'air vital = le dioxygène
et
La mofette = le diazote.
Pourcentage d'air vital
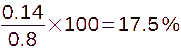
Il y a 21% de dioxygène
dans l'air.
Il y a 0,146% de dioxygène
donc on ne peut pas respirer sur Mars.
Sur Terre, il a 0,04% de
dioxyde de carbone et 95,97% sur Mars
Conclusion
L’air est un mélange de
diazote, de dioxygène et aussi d’autres gaz mais en très petite
quantité.
Il y a : 21% de dioxygène ( 1/5
du volume )
78% de diazote ( 4/5 du
volume )
1% d’autres gaz
Activité documentaire
Lavoisier
(1743-1794) réalise en 1777, une expérience remarquable : il
chauffe très fortement du mercure dans un dispositif fermé
contenant de l'air.
À
la fin de l'expérience, il
constate que 0,14 L d'air sur les 0,8 L du départ a
disparu : Il s'est combiné au mercure pour former de l'oxyde
de mercure. Il teste le gaz restant avec une souris et s'aperçoit
qu'elle ne peut pas respirer.
Lavoisier
en conclut que l'air est composé de deux gaz différents :
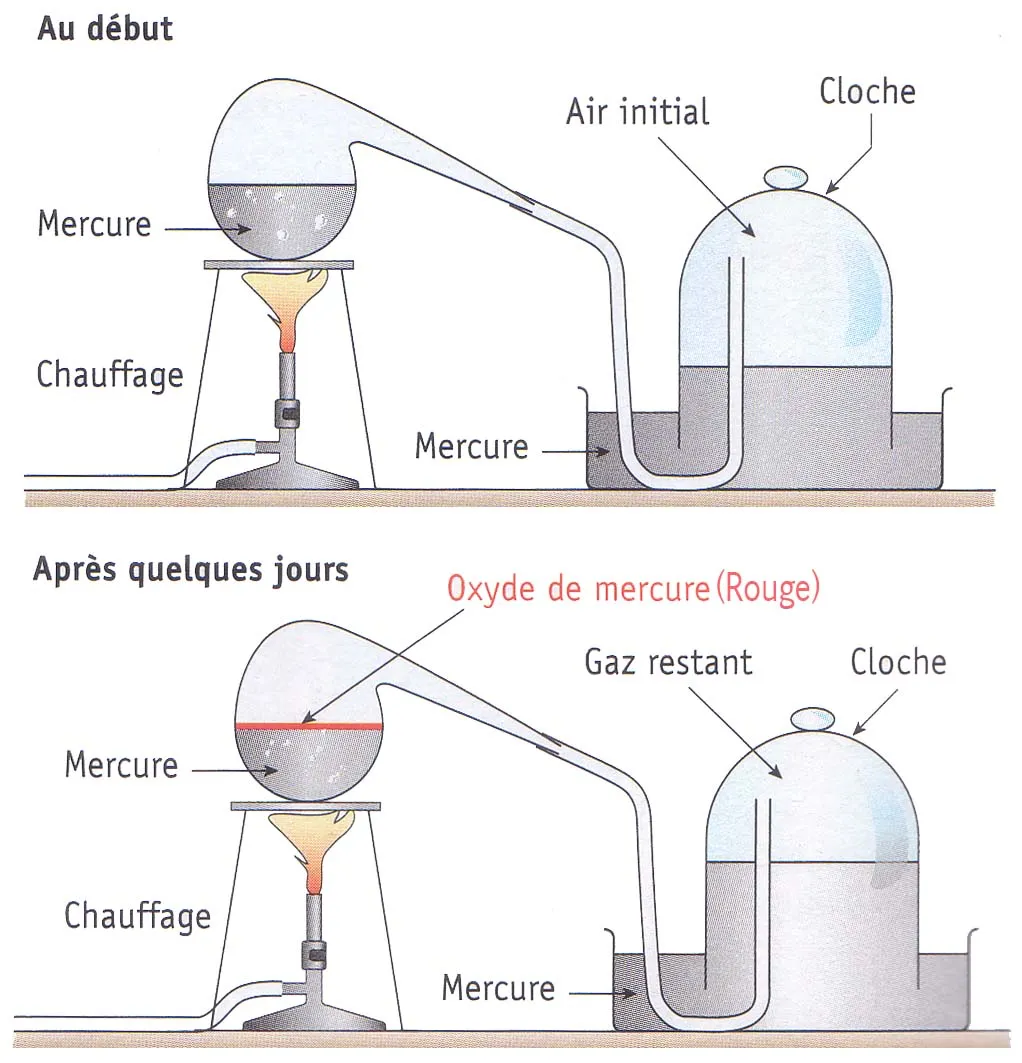
|
Atmosphère
terrestre
|
|
Atmosphère
Martienne
|
|
|
|
|
Informations
générales
|
Pression
atmosphérique
|
101 325 Pa
|
|
Pression
atmosphérique
|
6,36
mbar
|
Composition
|
Diazote
(N2)
|
78,084 %
|
|
Dioxyde
de
carbone (CO2)
|
95,97 %
|
Dioxygène
(O2)
|
20,953 %
|
|
Argon
(Ar)
|
1,93 %
|
Argon
(Ar)
|
0,9340 %
|
|
Diazote
(N2)
|
1,89 %
|
Dioxyde
de
carbone (CO2)
|
0,04 %
|
|
Dioxygène
(O2)
|
0,146 %
|
Neon(Ne)
|
0,02 %
|
|
Monoxyde
de
carbone (CO)
|
0,0557 %
|
Vapeur
d'eau
(H2O)
|
de
< 5 %
|
|
Vapeur
d'eau
(H2O)
|
0,03 %
|
Quelle
idée, Lavoisier veut-il prouver en réalisant son
expérience ?
___________________________________________________________________________
Quel
est le nom scientifique des “deux airs”
?
___________________________________________________________________________
Calcule
le pourcentage d'air “vital” contenu dans l'air
initial.
___________________________________________________________________________
Quel
est le pourcentage réel d'air vital sur Terre
?
___________________________________________________________________________
Quel
est le pourcentage de cet air vital sur Mars ? Que peut-on en
déduire
?
___________________________________________________________________________
Quel
est le pourcentage de dioxyde de carbone sur les deux planètes
?
___________________________________________________________________________
II -Les
propriétés physiques de l'air
II.1 -L'air a-t-il une masse ?
On pèse un ballon avant et
après gonflage et on regarde s'il y a une différence de masse.
Quand
il est plein,
le ballon est plus
lourd de ……1,7g……
Conclusion : L'air a une
masse
On remplit d'air une
bouteille par déplacement d'eau pour pouvoir retirer exactement 1
litre d'air. On pèse le ballon avant et après le remplissage pour
connaître approximativement la masse de l'air.
|
Observation :
Le
ballon est plus léger de _1,3_
g
|
Conclusion :
Dans les conditions
habituelles, la masse volumique de l'air est :
=1,2 g/L .
Rappel :
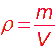
Application :
Quelle est la masse d'air dans la classe ?(approximativement)
Longueur : 10m
Largeur :
6m
Hauteur
moyenne : 4m
|
V=10x6x4=
240 m3
=1,2
g/L = 1,2 kg/m³
m=
x V
=1,2 x
240
= 288 kg
|
Exercice
22p102
a)
V=1,5 L
b)
m=21,8-18,2=3,6g
c)
=m/V=3,6/1,5=2,4g/L
II.2 -La
pression de l'air
A l'état gazeux une
substance utilise tout l'espace qui est libre. Pour ce faire, le gaz
se déplace et exerce une pression.
Pour mesurer une pression ,
on utilise un manomètre. L'unité
internationale de pression est le Pascal, on utilise aussi
l'atmosphère, le bar et le millimètre de mercure.
1atm = 1,015
bar = 1015 hPa = 760mmHg
Mise en évidence de la
pression en changeant le volume d'air
On utilise une seringue
bouchée avec le doigt puis relié à un manomètre électronique.
Que peut-on observer ?
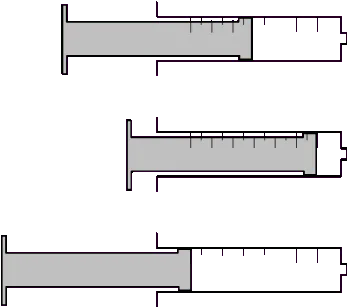
|
Repos
|
Le volume diminue, la
pression augmente : Compression
|
Le volume augmente, la
pression diminue : Détente
|
Conclusion :
Un gaz est toujours
compressible.
A quantité constante :
Si le
volume d'un gaz augmente, sa pression diminue → Détente
Si le volume diminue, sa pression augmente →Compression.
4ème Chapitre 5 : L’air Thème 1
Page 4 / 4