Les énergies possibles sont :
Énergie Mécanique
Thermique
Lumineuse
Chimique
Électrique
Nucléaire
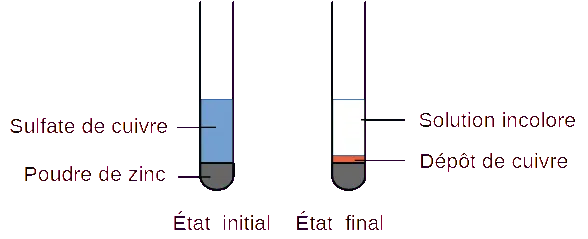
On réalise l'expérience ci-dessous en suivant l'évolution de la température pendant la transformation chimique.

Observation
Pendant la transformation la température augmente. La solution est devenue incolore et un dépôt orange est visible sur le zinc.
Étude des produits
Il n’y a plus d’ions cuivre bleue, le dépôt orange doit être des atomes de cuivre.
On fait un test à la soude sur la solution finale. On obtient un précipité blanc donc les atomes de zinc se sont transformés en ions zinc.
Cu2+
+ Zn
![]() Cu
+ Zn2+
Cu
+ Zn2+
|
|
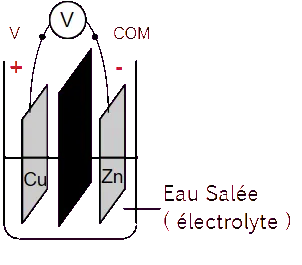
On remplit à moitié un bécher contenant de l’eau salée.
On place une lamelle de zinc et une lamelle de cuivre dans un bécher. Ce sont les électrodes de notre pile.
 U=0,67
V
U=0,67
V
Quelle est la tension mesurée ? 0,67 V
Quelle est l’électrode positive ? L’électrode de cuivre
Quelle est l’électrode négative ? L’électrode de zinc
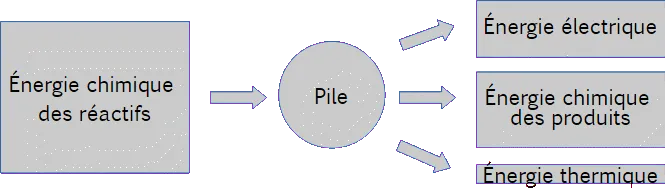
Sous quelle forme est stockée l’énergie d’une pile qui ne fonctionne pas :
Complète le schéma représentant les conversions d’énergies d’une pile qui fonctionne.
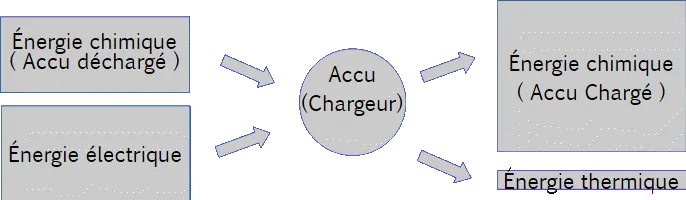
Dans un accumulateur, les électrodes doivent permettre la réaction dans les deux sens.
Identifie les énergies lors du rechargement de l’accumulateur et réalise le schéma énergétique correspondant.
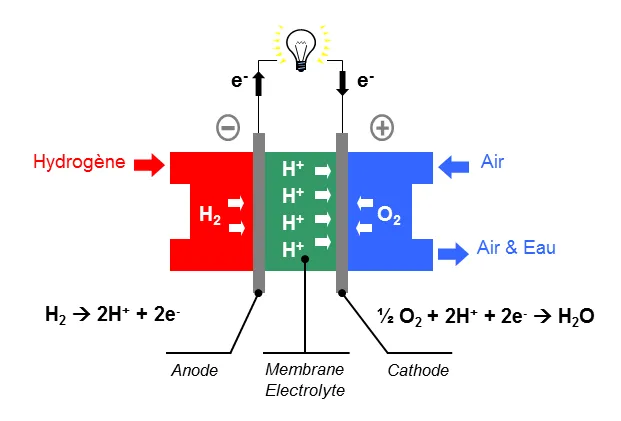
La pile à combustible ou pile à hydrogène est une pile qui utilise aussi deux électrodes et une membrane remplaçant l’électrolyte.
H₂
![]() 2H⁺
+ 2e⁻
2H⁺
+ 2e⁻
+
½O2
+
2H⁺
+ 2e⁻
![]() H2O
H2O
--------------------------------
H₂+
½O2
+
2H⁺
+ 2e⁻
![]()
2H⁺
+ 2e⁻
+ H2O
H2
+ ½O2
![]() H2O
H2O
Les réactifs sont le dioxygène et le dihydrogène. Les électrodes sont faites d’un matériau catalyseur. ( il permet la réaction sans être consommé ).
La voiture à hydrogène ne produit que de l’eau