Le pH est une grandeur qui caractérise les solutions aqueuses. Sa valeur ( sans unité ) est comprise entre 0 et 14.
Si le pH est < 7 |
La solution est acide |
Elle contient plus d'ions H+ que d'ions HO- |
|
Si le pH est = 7 |
La solution est neutre |
Elle contient autant d'ions H+ que d'ions HO- |
|
Si le pH est > 7 |
La solution est basique |
Elle contient moins d'ions H+ que d'ions HO- |
H+ : ion hydrogène HO- : ion hydroxyde
Le pH se mesure avec du papier pH ou un pH-mètre.
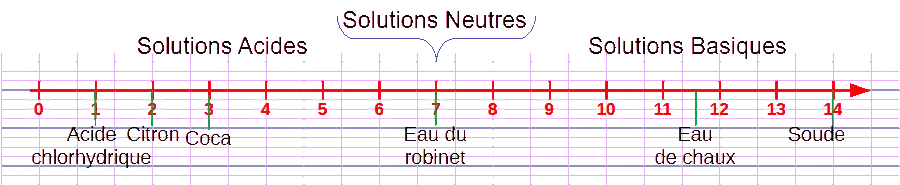
On peut utiliser une échelle de pH pour représenter l'acidité ou la basicité des solutions.

À l'aide du matériel disponible, on détermine le pH des produits suivants et on les place sur l'échelle de pH :
Eau de chaux |
pH=12 / pH=11,6 |
Eau du robinet |
pH=7 |
Coca |
pH=3 |
Acide Chlorhydrique |
pH=1 |
Soude |
pH=14 |
Citron |
pH=2 |
Sécurité
Les solutions acides et basiques concentrées sont fortement corrosives. Sur leur flacon doit figurer le pictogramme de sécurité correspondant. |
|
À cause des projections possibles, on ne doit jamais verser de l'eau dans une solution corrosive concentrée.
On réalise le montage de droite :
On place une solution d’acide chlorhydrique dans le bécher et une solution de soude dans la burette.
On suit la température et le pH lors de l’ajout de la soude.
Que peut-on observer ? La température augmente et le pH aussi puis le pH dépasse 7 et la température n'augmente plus.
Pour quelle raison le pH augmente ? Au départ, la soude réagit avec l'acide et la quantité d'acide diminue. Ensuite l'ajout de soude augmente le pH mais sans réaction. |
|
Les ions hydroxydes de la soude neutralisent les ions hydrogène de l’acide chlorhydrique suivant l’équation :
H+ + HO- → H2O
Quel test simple peut-on faire pour tester la poudre de fer ?
On utilise un aimant
Pour connaître la composition de l’acide chlorhydrique, on réalise un test de pH et le test des ions chlorures.
Test du pH : pH = 1
Test des ions chlorure : positif ( obtention d'un précipité blanc avec le nitrate d'argent)
Verse une petite quantité de poudre de fer dans un tube à essai.
Ajoute 4 mL d’acide chlorhydrique sur le fer
Bouche le tube à essai
Réalise le schéma de la réaction
Schéma
|
Observation :
|
Le test à la flamme :
Lorsque l'on place une allumette au dessus du tube, il y a une petite explosion avec un bruit caractéristique appelé « aboiement ». Le produit mis en évidence par le test à la flamme est le dihydrogène H2 .
Ceci constitue le test de caractérisation du dihydrogène H2.
Le test à la soude
|
Observation :
|
Le produit mis en évidence est des ions fer II Fe2+
Le test au nitrate d'argent
On réalise un test au nitrate d'argent pour voir s'il reste des ions chlorures. Le test est positif, il y a toujours des ions chlorures.
Écrire l'équation-bilan de la réaction sachant que lorsqu'un ion est présent au départ et à la fin, on ne l'écrit pas. N'oubliez pas d'équilibrer la réaction.
Fe + 2H+ → Fe2+ + H2
Les ions Cl- sont des ions spectateurs