On réalise un montage à l'aide d'un électrolyseur qui nous permet de tester si une solution est conductrice de courant.
On commence par recouvrir les électrodes avec de l'eau déminéralisée puis on y dissout du sucre puis du sel.
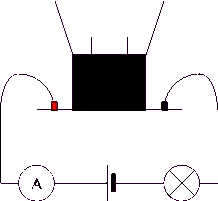
On réalise un montage à l'aide d'un électrolyseur qui nous permet de tester si une solution est conductrice de courant.
|
|
L'ajout de sucre a-t-il rendu conductrice la solution ? Non
L'ajout de sel a-t-il rendu conductrice la solution ? Oui
Le sucre dans l'eau reste sous forme de molécules C6H12O6 alors que le sel de formule NaCl est dissous sous forme d'entités Na+ et Cl- appelés ions.
Un ion est un atome ou une molécule qui a gagné ou perdu un ou plusieurs électrons.
Un ion négatif est un ion qui a gagné des électrons ( il a gagné des charges négatives )
Un ion positif est un ion qui a perdu des électrons ( il a perdu des charges négatives)
Les solutions contenant des ions sont électriquement neutres.
Pour écrire la formule d’un ion, on écrit la formule de l'entité ( atome ou molécule ) puis on ajoute en exposant (en haut à droite) la différence entre le nombre de charges positives et le nombre de charges négatives.
L'atome de magnésium et l'ion magnésium
|
-2 ē |
|
Mg |
|
Mg2+ |
L'atome de fluor et l'ion fluorure
|
+1 ē |
|
F |
|
F- |
La solution de fluorure de magnésium
La solution contient les ions Mg2+ et F- , sa formule est : Mg2+ +2F-
La formule du sulfate de cuivre anhydre ( solide ) est CuSO4 et il devient en solution Cu2+ + SO42- .
Calcule le nombre total de protons et d’électrons par ion.
Cu2+ |
p : 29 |
ē : 29-2=27 |
SO42- |
p :16+4x8=48 |
ē : 48+2=50 |
On verse une solution de sulfate de sodium qui servira de témoin et une solution de chlorure de sodium dans deux tubes à essais. Puis on verse quelques gouttes de nitrate d'argent dans les deux tubes.
|
|
État initial |
État final |
Observation : On observe dans le tube contenant les ions chlorures, la formation d'un précipité blanc quand on ajoute le nitrate d’argent.
Exemple : L'eau du robinet contient-elle des ions chlorures ?
On verse environs 4 cm3 d'eau du robinet dans un tube à essai. On verse quelques gouttes de nitrate d'argent dans le tube.
On observe un précipité blanc . Le test est positif. L’eau du robinet contient des ions chlorures.
Le test de caractérisation des ions métalliques se fait avec une solution de soude.
Avec l'ajout de quelques gouttes de soude, il apparaît un précipité coloré.
Voir compte-rendu de TP.
Nom de l'ion |
Fer II |
Fer III |
Cuivre II |
Zinc |
Chlorure |
Formule de l'ion |
Fe2+ |
Fe3+ |
Cu2+ |
Zn2+ |
Cl- |
Réactif |
Soude |
Soude |
Soude |
Soude |
Nitrate d'argent |
Précipité |
Verdâtre |
Rouge
brique |
Cyan |
Blanc |
Blanc |
Exercice 11, 12 et 13 p141 partie exercice
11p 141
Les deux premiers tubes ont été inversés.
12p141
a) Il faut porter des gants et un vêtement de protection et des lunettes car la soude est corrosive.
b) les ions de fer III sont mis en évidence par la soude et les ions Chlorure sont mis en évidence par le nitrate d’argent.
c) C’est une solution de Chlorure de Fer III. ( 3Cl- + Fe3+ )
13p141
On dissout la crème dans de l’eau déminéralisée. On verse quelques gouttes d’eau salé ( solution de chlorure de sodium ). On devrait voir un précipité blanc.
Migrations des ions
Matériel : 1 Générateur, 1 ampèremètre, 1 DEL, 2 électrodes en graphite, 1 bande de fromage, une solution bleue contenant des ions positifs, une solution jaune contenant des ions négatifs.
Comment
sait-on qu'il y a du courant dans tout le montage ?
__ La
DEL du montage est allumée
et l'ampèremètre mesure une intensité _________
|
|
Pourquoi
parle-t-on de migration des ions ?
_ On
observe que
les ions
colorés se déplacent
vers l'électrode positive ou
vers l'électrode négative __
Application : L'ion sulfate est composé d'un atome de soufre et de quatre atomes d'oxygène. L'ion sulfate est accompagné d'un seul ion cuivre II Cu2+ dans le sulfate de cuivre.
Donne la formule de l'ion sulfate.
Lors de l'expérience de migration des ions, vers quelle électrode se dirige les ions sulfate.
Combien d'électrons composent l'ion sulfate.
S
1 fois et O 4 fois SO4 mais quelle est la
charge ?
Sulfate est en paire avec Cu2+ donc
sulfate est chargé 2-
Sulfate SO42-
L'ion est négatif donc il se déplace vers l'électrode positive
1x16 électrons ( S )+ 4x8 électrons ( O ) + 2 électrons en plus donc 50 électrons au total.
Partie exercice : 19p142
a) ion « going » veut dire allant.
b) A : anode B :Cathode C : anion D : Cation